- Optimización en biorreactores del medio para producción de células
- Optimización de Medios de Cultivo Celular para la Producción Máxima de Proteínas
- Optimización de Cultivos Microbianos para una Producción Máxima
- Diseño de experimentos y biorreactores (DoE)
- Comparación de métodos DoE para la optimización de la producción en biorreactores
Estrategia para Utilizar Sensores Virtuales en Biorreactores
Una estrategia para utilizar sensores virtuales en biorreactores como herramientas de PAT debería basarse en el equilibrio entre las necesidades del usuario y las limitaciones de los sensores virtuales, como se discutió anteriormente.
Una clasificación del rendimiento analítico frente a los requisitos del usuario podría ser la manera eficiente de seleccionar la configuración de sensor virtual más relevante. Esto debería implicar, en algún nivel, también una evaluación económica.
Una evaluación del rendimiento analítico en comparación con los requisitos del usuario podría ser la forma eficiente de seleccionar la configuración de sensor virtual más relevante. Esto debería incluir, en algún nivel, también una evaluación económica.
Los sensores supervisan el estado de las células, su número o viabilidad, los metabolitos o proteínas circundantes producidos por las células, componentes del medio de crecimiento añadido ya sea en fase líquida o gaseosa del reactor. En algunos casos, el monitoreo está motivado tanto antes como después de la unidad, en otros solo después o en la unidad.
En (d), el ejemplo con tres unidades secuenciales, se monitorea la conversión gradual en el procesamiento. La estrategia de utilizar sensores virtuales en biorreactores también se puede extender a configuraciones aguas abajo; las configuraciones ilustradas en (e)-(g) muestran cómo los dos flujos de efluentes reflejan la eficiencia de la separación lograda en la unidad.
Los objetivos principales de utilizar las señales del sensor en estos ejemplos son reflejar la pureza del producto principal a nivel celular, proporcionar señales para acciones de control y supervisar la eficiencia del proceso para aprovechar las materias primas o alertar cuando se necesita iniciar una acción de control o un cambio en el proceso.
La utilidad de estos parámetros del proceso es evidente cuando se trata de la toma de decisiones. Esto puede basarse en reflejar un estado metabólico o fisiológico, que es crucial para cambiar las operaciones del proceso y que tiene un efecto directo en la productividad, calidad o eficiencia en el uso de las materias primas.
Estudios previos con sensores virtuales en biorreactores han ejemplificado y demostrado una variedad de alternativas. Estas alternativas deben ser evaluadas y comparadas desde una perspectiva estratégica y en relación con criterios de aplicación.
Una configuración típica de biorreactor a escala de laboratorio proporciona señales en tiempo real para varios parámetros operativos como temperatura, presión, tasa de aireación, pH y pO2. Un biorreactor bien equipado también puede contar con un analizador de gases y un sensor de densidad celular como estándar.
Aplicaciones de Sensores Virtuales en Biorreactores
Las configuraciones de los sensores virtuales en biorreactores en estos ejemplos promueven la estrategia de optimizar la productividad, mejorar la reproducibilidad y reducir la variación de calidad. Y se logra mediante la combinación de sensores en línea y conocimiento científico.
Espectrometría de fluorescencia en línea para estimar los componentes del medio en un biorreactor.
Las concentraciones de biomasa, glucosa y etanol se predicen a partir de espectros escaneados analizados por modelos PLS segmentados. Los modelos de predicción fueron calibrados con datos estándar de proceso en línea y mostraron un bajo error cuadrático medio de predicción (RMSEP) para etanol y glucosa, correspondiente al 4%, 2% y 2% de los respectivos intervalos de concentración.
Estos cultivos de biorreactores por lotes se realizaron utilizando Saccharomyces cerevisiae a concentraciones de biomasa altas (con 190–305 g/L de glucosa) y bajas (con 21–25 g/L de glucosa), utilizando el método de fluorescencia de longitud de onda múltiple y sensores de monitoreo estándar. Se calibraron modelos de mínimos cuadrados parciales para predecir el peso seco celular en tanques de acero, el etanol y la glucosa consumida, utilizando los dos tipos de datos por separado.
Las cultivaciones de baja densidad consistieron en dos fases diaúxicas (captación de glucosa con producción de etanol seguida de captación de etanol después del agotamiento de la glucosa), lo que requirió modelos diferentes para las dos fases, pero mejoró significativamente las predicciones.
Los modelos de predicción calibrados con datos estándar del proceso en línea mostraron RMSEPs similares o más bajos en comparación con los modelos de fluorescencia. Los mejores modelos de predicción para cultivaciones de alta densidad tuvieron RMSEPs de 1.0 g/L de biomasa celular (CDW), 1.8 g/L de etanol y 5.0 g/L de glucosa consumida, correspondientes al 4%, 2% y 2% de las concentraciones, mientras que los modelos de baja densidad tenían 0.3 g/L de CDW, 0.7 g/L de etanol y 1.0 g/L de glucosa consumida, correspondientes al 4%, 8% y 4% de las concentraciones.
Algoritmos en los sensores blandos en biorreactores
Los algoritmos en los sensores blandos utilizan modelos y métodos de cálculo más o menos complejos. Los enfoques más comunes son los modelos basados en análisis de datos multivariados (MVDA).
La interpretación de datos analíticos en biorreactores o señales de espectrometría NIR y MIR, fluorometría, espectrómetros de masas y narices electrónicas [así como la combinación de datos de diferentes técnicas analíticas] son ejemplos de instrumentaciones de hardware donde se aplican con éxito métodos de MVDA.
Los instrumentos espectrométricos en los que los datos se superponen en espectros actualizados continuamente y donde las señales espectrales se desconvolucionan en conjuntos de variables de estado analíticas son especialmente atractivos como sensores blandos.
Una aproximación de modelo alternativa y popular al análisis de datos multivariados (MVDA) es la red neuronal artificial (ANNs, por sus siglas en inglés).
Se requieren extensas calibraciones y ajustes para sintonizar los parámetros en los modelos MVDA y ANN según la situación de medición real, por ejemplo, la cultura, el entorno del medio y los analitos.
Sin embargo, las técnicas MVDA y ANN son flexibles en su uso y podrían proporcionar muchas alternativas para predecir datos relevantes para los objetivos de la Tecnología de Análisis de Procesos (PAT).
Los algoritmos basados en modelos mecanicistas a veces son la elección preferida debido a su adherencia a eventos y procesos biológicos reales, y al hecho de que los datos analíticos son más fáciles y en su mayoría posibles de relacionar con modelos teóricos aceptados en la bioingeniería.
Típicamente, los algoritmos se derivan de balances de masa y ecuaciones cinéticas para los sistemas biológicos que pueden implementarse fácilmente en el sensor blando con un trabajo bastante limitado.
Los esfuerzos más exigentes serán determinar los valores de los parámetros en los modelos a partir de datos experimentales.
A menudo, los usuarios de sensores blandos no quieren ser obstaculizados por esto y, por lo tanto, prefieren los modelos no deterministas al vincular entradas y salidas según funciones de peso o factores polinómicos.
Desafortunadamente, esto puede resultar en que eventos o rutas metabólicas críticas puedan quedar ocultos en un conjunto de factores numéricos derivados únicamente de experimentos de calibración y entrenamiento.
No obstante, los métodos de mínimos cuadrados parciales (PLS) y las redes neuronales artificiales (ANN) son métodos de modelado comunes que se han aplicado con frecuencia en sensores blandos.
Esto es evidente en casos como narices electrónicas y lenguas electrónicas, donde los sensores de gas y las señales de electrodos sensibles a iones se utilizan como entradas para los modelos PLS o ANN vinculados a salidas como concentraciones de analitos en el medio, biomasa o proteínas expresadas.
Lo mismo se ha logrado con éxito con frecuencia con espectros de masa y ópticos.
Las combinaciones de enfoques de modelado también son alternativas interesantes, como modelos híbridos, así como otras opciones, como algoritmos genéticos y métodos de inferencia.
A veces, las tareas de cálculo para los sensores blandos son sencillas y directas, por ejemplo, sumar, restar, multiplicar o dividir dos valores de señal, como cuando se convierten tasas volumétricas a tasas específicas, se calculan factores de rendimiento o se filtra el ruido.
Aunque bastante simples de implementar, esta información puede tener un gran valor para la comunicación del operador, la toma de decisiones y como puntos de referencia de control.
La validación del rendimiento del sensor blando es un paso muy crítico para la evaluación de su utilidad en la fabricación. Por lo general, los conjuntos de datos de calibración se separan de los datos de validación y se aplican métodos estadísticos y criterios de rendimiento.
Depende del usuario decidir estos criterios y el nivel de las estimaciones del sensor blando que es suficiente para su propósito. En modelos de PLS y ANN, los procedimientos estándar de validación están ampliamente descritos y normalmente se siguen.
En modelos mecanicistas, las correlaciones con métodos de referencia confiables para las variables estimadas son fundamentales.
Las pautas de validación del proceso de las autoridades regulatorias son útiles y aplicables a la validación de sensores blandos.
También se ha sugerido considerar procedimientos de autovalidación incorporados en el sensor blando.
Un comentario general es que depende de las preferencias del usuario elegir un enfoque.
Puede ser que en gran medida el conocimiento del proceso necesario para establecer un modelo mecanicista esté disponible y que los parámetros del modelo estén previamente determinados para las condiciones o el espacio de diseño o control actual.
En ese caso, puede resultar atractivo utilizar ese modelo en el sensor blando. Sin embargo, puede haber muy poco conocimiento previo, lo cual podría ser el caso, por ejemplo, en productos de terapia celular u otros sistemas biológicos complejos. Esto favorecería el uso de modelos de PLS o ANN en el sensor blando.
Alternativas de sensores de hardware en biorreactores.
Obviamente, los dispositivos detectores de sensores (en un sensor virtual a menudo referido como el «sensor de hardware») que entregan las señales a los algoritmos son los componentes decisivos del sensor virtual; si no cumplen con los criterios necesarios, especialmente en sensibilidad y robustez, el sensor virtual no logrará cumplir su propósito. Los sensores de hardware deben ser capaces de cumplir con los objetivos de la Tecnología de Análisis en Proceso (PAT) de hardware en biorreactores y, cuando se combinan con un algoritmo de sensor virtual, proporcionar datos analíticos de calidad suficientemente buena. Lograr las necesidades de fabricación depende en gran medida de la capacidad y rendimiento del hardware.
Los sensores virtuales también presuponen la detección en tiempo real, normalmente realizada por dispositivos en línea o en línea, ya sea de manera invasiva o no invasiva. Si esto no es posible, y esto ocurre a menudo en el caso de parámetros biológicos críticos, deben considerarse otras soluciones y estrategias.
Los criterios y objetivos analíticosde hardware en biorreactores como la facilidad de uso, desechable, tiempo de respuesta (justo a tiempo), precisión y precio, deben compararse, evaluarse y clasificarse. Si esto resulta imposible, por ejemplo, debido al tipo de datos biológicos que deben estar disponibles para inferir información útil para las decisiones del proceso (control de retroalimentación, acciones secuenciales, etc.), se requiere una estrategia de monitoreo más refinada.
Varias alternativas de sensores cumplen con los criterios de bajo costo, así como con la robustez y confiabilidad. Desafortunadamente, estos sensores no proporcionan los parámetros más críticos del proceso biológico. Sin embargo, son muy esenciales para mantener condiciones físicas y químicas del hardware en biorreactores en el bioproceso, como temperatura, presión, electrodos de pH y pO2. Además, pueden proporcionar señales que son valiosas para integrar en algoritmos de sensores virtuales.
Varios de los sensores son estándar en equipos de procesos existentes. En parte, esto se puede atribuir a la confiabilidad, durabilidad, estabilidad y bajo precio de estos sensores. Otras alternativas comunes de bajo costo son los analizadores de gases y métodos de varilla de inmersión para metabolitos y componentes nutritivos. Estos últimos aún no están disponibles comercialmente para uso en línea, pero podrían realizarse técnicamente.
Algunos de los sensores de bajo costo son ideales para los sensores virtuales. Varios sensores de hardware en biorreactores también presentan un rendimiento analítico bueno a muy bueno en cuanto a sensibilidad y estabilidad, mientras que otros, como los electrodos, pueden requerir recalibración debido a la obstrucción y otros efectos de deriva.
La cromatografía líquida de alto rendimiento en línea y la espectrometría de masas en línea son ejemplos de instrumentos independientes más caros con la capacidad de proporcionar datos en línea para proteínas, metabolitos u otros compuestos de bajo peso molecular. Estos métodos son más costosos de configurar en combinación con sensores virtuales, requieren un soporte significativo y vigilancia por parte del operador, pero podrían, en muchos casos, suministrar datos de proceso confiables y valiosos en un corto período. En esta categoría, también encontramos otras alternativas en línea, como sondas capacitivas, sensores calorimétricos, narices electrónicas y lenguas electrónicas. Estos instrumentos son opciones exigentes para los sensores virtuales, a veces lo suficientemente precisos pero menos robustos de usar.
Los métodos espectrométricos en línea, como el NIR, MIR, Raman y la espectrometría de fluorescencia multionda, requieren extensas calibraciones y validaciones de las configuraciones de sensores virtuales para la predicción precisa de los componentes en los medios de proceso. Sin embargo, estos métodos tienen la ventaja de una respuesta rápida. Si los medios de proceso no son demasiado complejos, se pueden esperar señales puras y buenas predicciones, especialmente para moléculas pequeñas. Esto puede ser difícil en medios de biorreactores, pero en el procesamiento aguas abajo, por ejemplo, el NIR y la fluorescencia pueden mostrar una alta reproducibilidad y, por lo tanto, son alternativas viables incluso a gran escala.
Los sensores específicos de células pueden abordar parámetros importantes del proceso, como la morfología, el tipo de célula y los biomarcadores en la superficie celular, pero suelen ser difíciles de implementar de manera online. Esto incluye la microscopía, que normalmente requiere técnicos capacitados en microscopios, pero donde se están desarrollando microscopios automatizados para uso in situ en biorreactores. Además, los citómetros de flujo han mostrado interesantes posibilidades de aplicación en línea con modelos de sensores virtuales PLS. Es importante destacar que estas alternativas de hardware son particularmente importantes para considerar en el monitoreo de la fabricación de células madre o productos de terapia celular.
Métodos más exclusivos para biorreactores, como la resonancia magnética nuclear (NMR) en línea y la resonancia de plasmones superficiales mediante imágenes (imaging SPR), se consideran aquí como demasiado caros e irrealistas para justificar su aplicación en la etapa actual para soft sensors.
La aplicabilidad de la Tecnología de Análisis en Proceso (PAT) de las alternativas de hardware disminuye en las categorías de alto costo, aunque la relevancia biológica de los datos analíticos puede ser buena. El desarrollo adicional de sensores contribuiría a expandir la zona aplicable de PAT en la tabla. Es especialmente deseable calificar aquellos sensores de hardware con una alta relevancia biológica para un posible uso en PAT.
Diseño conceptual de sensores blandos para biorreactores
Los sensores blandos para biorreactores en el diseño de sistemas analíticos de procesos, desde una perspectiva de PAT (Proceso Analítico en Línea) o cualquier otro punto de vista, rara vez comienza con un análisis exhaustivo de las necesidades reales del fabricante.
Sin embargo, este debería ser el primer paso a seguir, como comúnmente se hace con otras tareas de diseño de ingeniería.
Las necesidades del fabricante de sensores blandos para biorreactores datos analíticos están básicamente vinculadas a los objetivos básicos de producción: (i) alta o definida calidad del producto y (ii) asegurar el costo de producción más bajo posible.
Como consecuencia, las necesidades de los sistemas analíticos de procesos están guiadas por estos dos objetivos.
Por las mismas razones, los objetivos de PAT se superponen en gran medida con estos.
Con esto como punto de partida, es muy probable que el fabricante mencione el análisis de la pureza del producto y la capacidad de medir subproductos y otras impurezas en tanques de acero que puedan surgir como necesidades de alto nivel; pero también, en qué etapa de la fabricación, con qué precisión, rapidez, frecuencia y con qué esfuerzo se analizan estos.
También es importante en cuanto a sensores blandos para biorreactores, aclarar cómo el fabricante desea utilizar la información analítica.
ser para retirar un lote de calidad demasiado baja, tomar decisiones sobre cómo o cuándo continuar el procesamiento en un paso posterior del proceso, o utilizar la información analítica para el control automático del proceso.
Un tema muy importante para el fabricante es que pueda confiar en el equipo analítico. Principalmente, esto se basa en la precisión, exactitud y repetibilidad de los datos analíticos.
Si se logra eso, el fabricante está dispuesto a aceptar un costo más alto para la instrumentación, al menos hasta que no incremente drásticamente el costo de producción.
Normalmente, los gastos en análisis de los sensores blandos para biorreactores no son tan altos en comparación con el costo total de producción.
Sin embargo, procedimientos analíticos demasiado extensos en un proceso pueden opacar otras rutinas operativas en la fabricación.
Debido a eso, se prefieren análisis que tengan demandas logísticas menores.
Las necesidades de otros fabricantes están directamente relacionadas con la economía del proceso y el tiempo de procesamiento.
Esto podría incluir el análisis de la utilización de las materias primas para garantizar que prevalezcan condiciones óptimas en las etapas del proceso aguas arriba, o que los rendimientos del producto no se pierdan en las etapas de procesamiento aguas abajo.
Para dicha información analítica, el propósito suele ser poder ajustar las condiciones del proceso de inmediato mediante acciones de control.
Aunque las razones detrás de estas necesidades están relacionadas con la economía del proceso, los motivos de PAT son indirectamente posibles de derivar, como el ahorro de materiales y energía.
A un cierto nivel, el fabricante debe volverse específico del producto y debe estar directamente conectado al caso del producto real.
La producción, por ejemplo, de una proteína bioterapéutica en un cultivo de células mamíferas es diferente de un proceso de producción microbiana y, por lo tanto, tiene requisitos analíticos diferentes.
La creación de células para terapia celular difiere considerablemente de un proceso de cultivo celular para una proteína bioterapéutica.
La generación de vectores para terapia génica tiene un diseño de proceso que se desvía de otros procesos de varias maneras.
Cuando las necesidades analíticas se proporcionan con valores objetivo, se puede establecer un mapa mucho más preciso de las necesidades del fabricante.
Esto permite clasificar la importancia de las necesidades analíticas, lo que facilitaría el diseño del sistema analítico.
Con el apoyo del mapeo, se establecen los límites para el diseño del sistema analítico. Una vez hecho esto, se pueden considerar seriamente enfoques de sensores blandos.
Diseño de Sensores de Software para Monitoreo y Control de Biorreactores
El término «sensores de software para biorreactores» se utiliza con frecuencia para describir la combinación de sensores «hardware» con modelos implementados en software, donde estos últimos utilizan las señales del hardware para derivar nueva información. El proceso puede ser un solo biorreactor o, por supuesto, un bioproceso completo que incluya tanto el procesamiento aguas arriba como aguas abajo. Como ilustra la figura, el sensor suave opera en línea con el proceso, en tiempo real, y las señales recopiladas suelen ser más de una.
El principio del sensor suave abre la puerta a una explotación más extensa de los sensores existentes y las señales de los mismos, así como a aprovechar el conocimiento previo de los mecanismos de los sistemas de procesos.
De esta manera, los sensores de software para biorreactores se vuelven útiles para aplicaciones de monitoreo y control en la industria procesadora, pero también, debido a la generalidad de su principio, pueden utilizarse en cualquier proceso continuo o transformación donde estén disponibles señales de sensores para modelar. En los más de 1000 informes de sensores suaves que aparecen en la literatura de ingeniería, las aplicaciones a productos químicos básicos y procesos metalúrgicos, control de operaciones unitarias, energía y medio ambiente son dominantes, mientras que los ejemplos de uso en biotecnología son relativamente pocos.
Para ser atractivos para su uso en la industria, especialmente en aplicaciones de biorreactores, los sensores de software para biorreactores deben basarse en sensores y modelos que sean robustos y fáciles de operar, y la configuración resultante del sensor suave debe poder validarse de manera convincente.
Esto requiere simplicidad tanto para el hardware como para el software, tanto para dispositivos como para métodos de cálculo. Con esto, un sensor suave debería proporcionar un sistema analítico menos complicado, reducir la necesidad de una vigilancia operativa extensa del propio sistema analítico, disminuir el trabajo operativo y de mantenimiento, y también conducir a una reducción en el costo del equipo.
La Perspectiva de la Tecnología Analítica de Procesos sobre los Sensores de Software.
Si se cumplen los criterios establecidos, los sensores de software para biorreactores también pueden ser una herramienta valiosa en el marco de la iniciativa de Tecnología Analítica de Procesos (PAT, por sus siglas en inglés). En particular, PAT describe un conjunto de herramientas y métodos para hacer que los procesos de fabricación farmacéutica sean más fiables y eficientes. El enfoque de razonamiento en PAT ha sido respaldado por varios organismos reguladores y la investigación académica ha estado activa en seguir estas direcciones en diversos aspectos como el diseño de calidad, el desarrollo de sensores en línea y el diseño experimental estadístico. Además, los principios de PAT y QbD pueden extenderse a todos los procesos de fabricación biotecnológica, incluyendo proteínas, alimentos y otros productos químicos.
La guía de PAT (Tecnología Analítica de Procesos) de la FDA de EE. UU. menciona seis objetivos que se deben lograr mediante el uso de las herramientas de PAT: (i) reducir el tiempo de ciclo de producción, (ii) prevenir el rechazo de lotes, (iii) permitir la liberación en tiempo real, (iv) aumentar la automatización, (v) mejorar la eficiencia en el uso de energía y materiales, y (vi) facilitar el procesamiento continuo. Se espera que estos objetivos sean aplicables a toda la producción farmacéutica, incluida la fabricación de medicamentos basados en proteínas bioterapéuticas (proteínas, anticuerpos), vectores de terapia génica, así como productos de terapia celular.Bottom of Form
De estos objetivos, los sensores de software para biorreactores pueden contribuir potencialmente especialmente al aumento de la automatización, debido a la posibilidad de utilizar señales para el control retroalimentado de las variables derivadas del sensor suave, y a la posibilidad de permitir la liberación en tiempo real, gracias a la provisión inmediata de estimaciones de parámetros críticos de calidad. Es posible suponer que esto podría tener un impacto significativo en la reducción del tiempo de ciclo, facilitando el procesamiento continuo y mejorando los balances de materiales debido a la provisión de información temprana en tiempo real para regular las condiciones de fabricación.
Aunque los sensores de software se aplican en muchas áreas de fabricación industrial, las aplicaciones relacionadas con procesos de fabricación, aplicaciones bioprocesadoras, biorreactores u otras operaciones bioprocesadoras están principalmente limitadas a demostraciones realizadas en laboratorios de investigación académica. Las razones de esto pueden deberse a que los parámetros del proceso biológico de interés son analíticamente menos estables y reproducibles que los parámetros que aparecen en aplicaciones en la industria mecánica, eléctrica y química. En principio, los sensores de software pueden aplicarse a biorreactores para respaldar los objetivos de PAT.
Métodos de regresión multivariante en biorreactores
El uso de métodos de regresión multivariante en biorreactores es particularmente útil en la estimación de AEC (Atributos Críticos de la Calidad) y PPC (Parámetros Críticos del Proceso) que no son fácilmente medibles en tiempo real.
El siguiente estudio de caso demuestra el uso de PLS en la estimación de las concentraciones de aminoácidos y de la forma de glicosilación en la producción de anticuerpos monoclonales utilizando cultivos de células híbridas.
Green y Glassey informaron que varios métodos multivariante en biorreactores de extracción de características de análisis de datos multivariados, como PARAFAC, PCA y PCA multivariado, fueron capaces de capturar las diferencias entre lotes realizados bajo diferentes condiciones de operación, destacando particularmente el impacto negativo de los altos valores de oxígeno disuelto y pH.
Estas observaciones en biorreactores de tanque de acero confirmaron las observaciones anteriores de Ivarsson et al. Posteriormente, se desarrollaron modelos de PLS utilizando datos en línea y fuera de línea para estimar parámetros importantes del proceso (como las concentraciones de aminoácidos durante los cultivos) y un AEC del anticuerpo monoclonal: sus formas de glicosilación.
Se desarrollaron varios modelos para cada variable de salida, resumiendo los modelos de estimación de aminoácidos, las variables de entrada y salida para cada uno de los modelos junto con el número de variables latentes y el rendimiento de los modelos en los conjuntos de datos de validación en términos del error cuadrático medio.
Claramente, los datos en línea fueron suficientes para estimar la concentración de algunos aminoácidos con precisión suficiente, aunque para otros aminoácidos (por ejemplo, ALA, GLU, GLY y VAL, números 1, 7, 8 y 20), la precisión es menor. Sin embargo, los beneficios en comprender el comportamiento del cultivo celular y la oportunidad de obtener estimaciones de parámetros metabólicos importantes en tiempo real son, sin duda, una ventaja significativa para comprender el estado metabólico del cultivo.
No obstante, sería aún más beneficioso poder estimar los AEC (Atributos Críticos de la Calidad), como la concentración de las glicoformas producidas por el cultivo celular. Las predicciones menos precisas se obtuvieron para las glicanos G0F y G1F. Las razones de esto están siendo investigadas actualmente.
Habíamos revisado los diversos sensores y técnicas analíticas utilizadas en la medición de procesos biológicos, tanto en procesos biotecnológicos tradicionales como en experimentos de alto rendimiento y a escala reducida. Se discutieron los desafíos introducidos por la variabilidad en la frecuencia de las mediciones y la gran cantidad de mediciones de diversas tecnologías de sensores (particularmente los métodos multianalíticos, como los métodos multivariante en biorreactores espectrales y «ómicos»). Se revisaron métodos específicos de preprocesamiento de datos, especialmente en el caso de datos espectrales.
Se proporcionó un breve resumen de PCA y PLS como ejemplos de métodos multivariante en biorreactores de extracción/clasificación de características y métodos de regresión. Se describieron variantes no lineales de ambos métodos de clasificación y regresión como alternativas a PCA y PLS.
Finalmente, se presentaron dos estudios de caso de procesos biotecnológicos. En el primer estudio de caso, se utilizó PCA para identificar las diferencias entre lotes de producción de 𝛽-galactosidasa recombinante de E. coli basados en datos del olfato electrónico monitoreados durante el cultivo.
En el segundo estudio de caso, se utilizó PLS para predecir la concentración de aminoácidos y los perfiles de glicosilación a partir de datos en línea y fuera de línea recopilados durante la producción de anticuerpos monoclonales utilizando cultivos de células hibridoma.
Estos estudios de caso resaltaron tanto los beneficios de enfoques como estos como los desafíos que se enfrentan en su aplicación, especialmente cuando los datos disponibles de los procesos son limitados y la comprensión fundamental de los procesos subyacentes es limitada.
Control de los procesos biotecnológicos
Hay una gran cantidad de desafíos en el monitoreo y control de los procesos biotecnológicos donde el análisis exploratorio de datos, la agrupación y la clasificación no cumplen con los requisitos de la aplicación específica. Por ejemplo, en los sensores virtuales (ver Capítulo 15), se requieren métodos de regresión que permitan predecir un atributo de calidad crítico deseado (CQA) o un Parámetro de Proceso Crítico (CPP) a partir de datos del proceso. En un mundo ideal, estos datos se obtendrían mediante mediciones analíticas oportunas, precisas y robustas. Sin embargo, la falta de técnicas apropiadas para medir CQAs, especialmente cuando están presentes en cantidades muy bajas en medios complejos, plantea la necesidad de estimación inferencial a través de la tecnología de sensores virtuales (ver Capítulo 15) de tales atributos y CPPs utilizando mediciones del proceso que están fácilmente disponibles. Esta parte del capítulo, por lo tanto, revisa brevemente los métodos de regresión establecidos, destacando especialmente sus aplicaciones en la modelización de biorreactores.
La técnica de regresión lineal más ampliamente utilizada para correlacionar variables causales (X) y variables de salida (Y) en una variedad de procesos es el método de mínimos cuadrados parciales (PLS, por sus siglas en inglés) y sus diversas modificaciones. El algoritmo PLS se basa en la proyección de las variables de entrada (X) y salida (Y) en un número de variables latentes e identifica la correlación de mínimos cuadrados entre estas nuevas variables mediante una regresión lineal de entrada única y salida única.
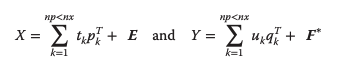
Donde E y F son matrices residuales, np es el número de componentes internos que se utilizan en el modelo, y nx es el número de variables causales.
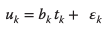
Donde bk es un coeficiente de regresión y 𝜀k se refiere al error de predicción. El desafío asociado con control de los procesos biotecnológicos y conjuntos de datos grandes recopilados utilizando métodos de medición multianalito (por ejemplo, métodos espectroscópicos u «ómicos») se aborda en parte gracias a la capacidad de PLS para reducir las dimensiones de los datos. Sin embargo, la evidencia muestra que la preselección de variables para el modelado de PLS puede mejorar significativamente el rendimiento del modelo. Por ejemplo, el PLS ortogonalizado (O-PLS) elimina la variación ortogonal con respecto a las variables de salida Y del conjunto de variables de entrada X. Utilizando este método, Yang et al. demostraron que la variabilidad óptica no relevante para los analitos en los espectros NIR de tejidos humanos les permitió tener en cuenta la superposición de tejidos y, por lo tanto, obtener una representación más precisa de las concentraciones de analitos dentro de un tejido específico.
La limitación reportada debido a la suposición de relaciones lineales entre las variables se aborda en una variedad de métodos alternativos de PLS. Estos incluyen la incorporación de relaciones polinómicas en la estructura de PLS, el uso de redes neuronales artificiales como modelos internos de PLS o estructuras híbridas que incorporan ecuaciones de balance de masas basadas en una comprensión de primeros principios del proceso. Al igual que con el control de los procesos biotecnológicos, los métodos de extracción de características y clasificación, las redes neuronales representan un enfoque alternativo de modelado de regresión no lineal con una amplia gama de ejemplos de aplicación en la modelización y monitoreo de procesos biotecnológicos.
Extracción de características utilizando PCA
Se presenta un ejemplo de la aplicación de la técnica de extracción de características en el control de los procesos biotecnológicos para identificar las diferencias en el rendimiento del biorreactor bajo diversas condiciones utilizando medidas de nariz electrónica para demostrar la utilidad de enfoques como este. Para este estudio de caso, se llevaron a cabo una serie de seis fermentaciones de E. coli recombinante y se utilizaron para investigar el efecto de los regímenes de inducción en la producción de 𝛽-galactosidasa. Durante estas cultivaciones, se utilizó una nariz electrónica híbrida comercial de la antigua Nordic Sensor Technologies A.B, Linköping (posteriormente Applied Sensors), NST 3320. La formación de 𝛽-galactosidasa en todos los lotes se indujo con isopropil-𝛽-d-tiogalactopiranósido (IPTG).
Dos de los lotes, denominados 1A y 1B, fueron inducidos temprano (durante la fase de crecimiento exponencial a las 19 horas de registro). Otros dos lotes, referidos como 2A y 2B, fueron inducidos durante la fase estacionaria a las 26-27 horas de registro. La cepa de E. coli con el vector de expresión operado por el promotor lac UV se utilizó en los cuatro de estos lotes. Las dos cultivaciones restantes, 3A y 3B, se llevaron a cabo como control de los procesos biotecnológicos. El lote 3A se indujo temprano a las 20 horas de registro y el lote 3B se indujo tarde a las 27 horas de registro. En estos dos lotes se utilizó una cepa que portaba un plásmido vacío, lo que resultó en la ausencia de producción de 𝛽-galactosidasa. Se midieron datos extensos en línea y fuera de línea, incluyendo temperatura, presión, pH, tasa de flujo de gas, porcentaje de O2 y CO2 en el gas de escape y porcentaje de oxígeno disuelto en el caldo, concentraciones de glucosa, ácido acético y formato, densidad óptica (600 nm) y peso en seco.
Cinco de los sensores de la nariz electrónica, concretamente aquellos sensibles al hidrógeno, metano y humedad, fueron eliminados del conjunto de datos antes del análisis debido a su falta de relevancia en esta aplicación.
Se realizó un análisis de componentes principales (PCA) en la parte de Respuesta de las señales de sensor restantes y se muestran los gráficos de puntuaciones para los datos de Respuesta sin procesar de los seis lotes. Esto se compara con el mismo análisis después de eliminar las variables insignificantes (lo que reduce la dimensionalidad de los datos de 120 variables a 49 variables).
En estas figuras, las puntuaciones de cada uno de los lotes se muestran en diferentes colores utilizando símbolos diferentes (ver leyenda). Claramente, la reducción de variables no ha afectado la capacidad del PCA para discriminar entre los lotes individuales. Los lotes que destacan por tener un perfil de puntuaciones diferente, es decir, 1A, 2A y en cierta medida 1B, fueron, por lo tanto, analizados en una comparación par a par para elucidar las diferencias observadas.
Modelización para monitoreo de bioreactores
En la modelización para monitoreo de biorreactores se toman en cuenta los desafíos introducidos por los datos recopilados de los bioprocesos, en particular la alta dimensionalidad de los conjuntos de datos resultantes, hacen que los enfoques multivariados para la modelización de datos de bioprocesos sean un requisito esencial. El uso de herramientas quimiométricas está bien establecido en otros campos científicos, especialmente en química, aunque su amplia aceptación en la modelización de bioprocesos se evidencia por la gran cantidad de publicaciones que informan sobre el uso rutinario de estas herramientas tanto en la investigación como en las aplicaciones industriales. Se presentan brevemente varios enfoques de modelización multivariada, tanto lineales como no lineales, con énfasis específico en su aplicabilidad para el monitoreo y control de bioprocesos.
A pesar de que el argumento en el monitoreo de biorreactores de utilizar métodos basados en la suposición fundamental de relaciones lineales entre las variables del proceso se cita con frecuencia como una limitación importante de los métodos lineales, estos siguen siendo ampliamente utilizados y aceptados en el análisis y modelado de datos de bioprocesos. A pesar del carácter no lineal de los bioprocesos, se ha demostrado que diversas modificaciones y preprocesamiento de datos permiten que los métodos lineales capturen de manera efectiva las características subyacentes de los bioprocesos modelados.
Extracción de características y clasificación
Uno de los métodos de análisis exploratorio de datos/extracción de características más frecuentemente descritos en la literatura de quimiometría es el análisis de componentes principales (PCA, por sus siglas en inglés). Esta técnica de monitoreo de bioreactores se utiliza con frecuencia como un enfoque de reducción de datos, especialmente antes de llevar a cabo un análisis de regresión adicional. Esta capacidad de reducción de datos resulta de la descomposición de la matriz de datos original de las mediciones del proceso (X) en un conjunto de variables no correlacionadas (componentes principales – PCs). Los PCs ortogonales resultantes son una combinación lineal de las variables originales del proceso, con el primer PC capturando la mayor parte de la varianza en los datos originales y los PCs subsiguientes capturando una proporción decreciente de la varianza, respectivamente.
La siguiente ecuación representa esta descomposición en términos de las matrices resultantes de puntajes (T) y cargas (P), y una matriz de error residual (E):
X=TPT +E
Dado que los componentes principales (PCs) se ordenan en función de la disminución de la varianza, es posible capturar las características subyacentes en los datos originales utilizando menos PCs, lo que reduce la dimensionalidad de los datos originales. Esto hace que el PCA sea especialmente adecuado en el monitoreo de biorreactores para el análisis de datos altamente dimensionales producidos por técnicas de huella dactilar y métodos multianalíticos, como técnicas espectroscópicas, narices y lenguas electrónicas, así como la salida de diversas mediciones «ómicas», según confirman numerosos informes en la literatura.
Las fuentes de literatura sobre la aplicación del PCA en el análisis de datos de bioprocesos abarcan una amplia gama de aspectos de los bioprocesos, desde la materia prima, el cultivo de semillas, la producción en lotes o el monitoreo de la calidad del proceso aguas abajo. La funcionalidad del PCA para la reducción de la dimensionalidad de los datos del proceso se utiliza típicamente en todas estas aplicaciones. El conjunto resultante de componentes principales se utiliza típicamente posteriormente como entradas en modelos de monitoreo de procesos dentro de esquemas de control estadístico multivariado de procesos (MSPC).
En una variedad de aplicaciones, el PCA y técnicas similares, como el análisis discriminante lineal/cuadrático/regularizado, los vecinos más cercanos o la agrupación jerárquica, se utilizan como «clasificadores», es decir, asignan muestras/objetos a una de las posibles clases en función de las mediciones recopiladas para la muestra/objeto dada en comparación con una biblioteca de muestras similares recopiladas a lo largo del tiempo. Estas aplicaciones en el monitoreo de biorreactores son particularmente útiles para identificar similitudes, por ejemplo, en datos de expresión génica recopilados a través de una variedad de microarrays de ADN/ARN o patrones en datos de metabolómica. En tales aplicaciones, el problema importante es especificar los criterios para discriminar entre las diversas clases. Los peligros de las decisiones arbitrarias en este sentido son discutidos por Glassey, donde se presenta un estudio de caso sobre el uso del PCA para discriminar entre lotes de producción de anticuerpos monoclonales recombinantes de alta y baja producción utilizando el sistema de expresión de Escherichia coli. Aunque inicialmente la agrupación de componentes principales parecía proporcionar una clasificación razonable para la discriminación requerida, un análisis más profundo reveló que la agrupación inicial arbitraria estaba más relacionada con la composición del alimento que con el título del producto.
En el control de calidad multivariado, típicamente en la industria alimentaria y potencialmente muy importante en la industria biofarmacéutica para asegurar la calidad del producto final, las técnicas mencionadas anteriormente suelen ser menos aplicables. En tales casos, es importante determinar sin lugar a dudas si el producto pertenece a una categoría en particular (por ejemplo, productos alimentarios no adulterados de una región específica). Forina et al. argumentan que esta tarea es más adecuada para las técnicas de modelado de clases (CMT), como UNEQ, SIMCA, POTFUN (modelado de funciones potenciales) y MRM (modelado de rangos multivariados). Estos métodos se discuten luego con más detalle en términos de su capacidad discriminatoria y su sensibilidad al ruido en los datos.
Para contrarrestar el argumento de la limitación de las técnicas de extracción y clasificación de características lineales, se introdujo un gran número de métodos no lineales. Estos no solo incluyen variantes no lineales de las técnicas lineales descritas anteriormente en el monitoreo de biorreactores, sino también técnicas basadas en redes neuronales artificiales, descritas con más detalle por Marini o Glassey. Este último también proporciona ejemplos de aplicaciones de bioprocesos de tales técnicas para identificar el estado fisiológico de la cultura y, por lo tanto, potencialmente mejorar la estimación de importantes parámetros del proceso.
Monitorización de Bioprocesos
Métodos alternativos de medición multianalito de bioprocesos, como biorreactores con sensores de nariz electrónica y las lenguas electrónicas, también se han utilizado con éxito en la monitorización de bioprocesos.
Estos tipos de enfoques son matrices multisensoriales, que frecuentemente utilizan una variedad de principios de transducción, como electroquímicos, gravimétricos y ópticos, tal como Rudnitskaya y Legin resaltan, junto con proporcionar un resumen de los materiales de detección respectivos y los analitos/aplicaciones.
Una ventaja particular de los biorreactores con sensores de nariz electrónica, frecuentemente destacada en la literatura, es su capacidad para medir analitos volátiles directamente en el espacio de cabeza/gas de salida sin necesidad de contacto directo con el medio de cultivo.
Además, podría haber retrasos temporales, especialmente para analitos de baja concentración, y los sensores podrían verse afectados por la deriva y la interferencia del vapor de agua.
Aunque la lengua electrónica puede requerir cierta preparación de la muestra para eliminar sólidos suspendidos a fin de que el medio líquido entre en contacto con la matriz de sensores.
Varios métodos «ómicos», en esencia, también producen una huella dactilar de las características del organismo o del entorno en el que se cultivan y podrían considerarse métodos de monitorización de huellas dactilares.
Ejemplos de herramientas genómicas, transcriptómicas, proteómicas y metabolómicas utilizadas para la monitorización de bioprocesos y para aumentar la comprensión demuestran el valor agregado que estos métodos pueden ofrecer en el desarrollo y operación de bioprocesos.
Características y Desafíos de los Datos para la Modelización
La diversidad de bioprocesos conduce a una variabilidad significativa en la calidad y cantidad de los datos del proceso medidos.
Como argumentan Vojinovic y colaboradores, las variables del proceso medidas, la frecuencia, la precisión y el retraso temporal se ven afectados por el proceso de fabricación que está siendo monitorizado.
En general, sin embargo, la multitud de métodos analíticos utilizados en la modelización de bioprocesos (consultar secciones anteriores) resulta en una cantidad sustancial de datos continuos y discretos de calidad variable y registrados a diversas frecuencias.
Este problema de la frecuencia variable y la gran cantidad de datos se ve exacerbado por el uso de tecnologías de alto rendimiento, donde el cuello de botella en el desarrollo de procesos se traslada de la disponibilidad de recursos para llevar a cabo los experimentos necesarios al análisis de datos de la gran cantidad de datos resultantes.
Por lo tanto, se requiere un procesamiento de datos significativo para que los datos puedan ser utilizados en el desarrollo de modelos de bioprocesos con fines de monitorización y control.
Este preprocesamiento y conciliación de datos pueden incluir la alineación temporal simple, el relleno de datos faltantes mediante interpolación o el uso de métodos más sofisticados.
Los datos espectroscópicos en particular han demostrado beneficiarse de un preprocesamiento adecuado para reducir las fuentes de variabilidad y ruido en los datos, y mejorar el contenido informativo del conjunto de datos resultante.
Estos métodos de preprocesamiento frecuentemente incluyen el centrado en la media (dado que los espectros se miden en las mismas unidades, esta estandarización suele ser satisfactoria), el uso de derivadas para eliminar el desplazamiento de la línea base o la variación de la pendiente, o diversos métodos de suavizado y corrección de dispersión.
Estos incluyen el suavizado de datos ruidosos mediante un filtro de Savitzky-Golay, la corrección de dispersión multiplicativa (MSC) y la variación normal estándar (SNV).
Uno de los principales desafíos para la modelización multivariante efectiva de datos de bioprocesos con fines de monitorización y control es la fusión de datos de diversas fuentes y con diversas características.
Es posible utilizar diversas representaciones matemáticas de los datos para capturar las características más relevantes de cada etapa del bioproceso, y las metodologías para combinarlas en un marco efectivo capaz de capturar el comportamiento completo del proceso aún no están suficientemente estandarizadas.
Métodos de medición avanzados en biorreactores
Con el rápido desarrollo de las técnicas analíticas, la categorización de los métodos en tradicionales y avanzados se está volviendo cada vez más arbitraria. Una amplia gama de técnicas consideradas avanzadas en la medición avanzada en biorreactores (al menos desde el punto de vista de la aplicación industrial) ahora se utilizan rutinariamente en el procesamiento de biomoléculas. Muchas de estas técnicas todavía se utilizan predominantemente fuera de línea, es decir, requieren muestreo manual o automático con transferencia de muestras a laboratorios especializados para su análisis. Sin embargo, ya se están aplicando técnicas en línea, frecuentemente in situ, con una sonda colocada dentro de un biorreactor o una operación unitaria desde donde se realiza la medición. El progreso más notable en el monitoreo de los bioprocesos se registró, como era de esperar, en la etapa de la parte aguas arriba (biorreactor). Se puede argumentar que esta etapa es la parte más desafiante del bioproceso desde el punto de vista del monitoreo y control, dada la complejidad del proceso y su impacto potencial en la calidad y cantidad del producto.
Los avances recientes en medición avanzada en biorreactores, particularmente en la tecnología de fibra óptica y el desarrollo de espectrómetros y sondas in situ robustas, hacen que los métodos espectrales de monitoreo de bioprocesos sean especialmente atractivos. En el sector de las bioindustrias, la espectroscopía, en particular la espectroscopía de infrarrojo cercano (NIR), se utilizaba tradicionalmente en la industria alimentaria. En el caso de la espectroscopía NIR, se destacaron características como alta capacidad de procesamiento, tiempo de respuesta corto, base rápida y no destructiva, capacidad de muestreo remoto, poca o ninguna preparación de muestras y la capacidad de proporcionar determinación simultánea de múltiples componentes por medición en tiempo real, especialmente beneficiosas para la industria alimentaria. Estas características son igualmente beneficiosas en otras áreas del procesamiento de biomoléculas.
Existen varios métodos de medición avanzada en biorreactores que se basan en la absorción de radiación en regiones específicas del espectro electromagnético, desde ultravioleta (UV) hasta ondas de radio, y se utilizan en diferentes grados en las bioindustrias. Tamburini y colaboradores describen varias técnicas y analitos medidos por estos métodos en función de la longitud de onda en la que operan. Lourenco y colaboradores ofrecen una visión general exhaustiva del análisis espectroscópico (UV/vis, NIR, infrarrojo medio (MIR), Raman y fluorescencia) en la amplia industria de los bioprocesos, incluyendo el ámbito medioambiental, agroalimentario, de biocombustibles y farmacéutico. Para cada aplicación, se muestran la escala de producción, los detalles del sistema espectroscópico utilizado, así como el método de análisis de datos quimiométricos y el modo de aplicación (monitoreo y control cualitativo/cuantitativo). Aunque la espectroscopía UV/vis, la fluorometría, la espectroscopía Raman y la espectroscopía de resonancia magnética nuclear (NMR) han demostrado ser útiles para el monitoreo de la biomasa, NADH, ATP, glucosa y otros metabolitos, la espectroscopía infrarroja, en particular la NIR, ha encontrado la aplicación más diversa tanto en la investigación como en la industria en las últimas décadas.
a capacidad de detectar grupos que contienen enlaces –CH (ya sean alifáticos, aromáticos o alquenos), –NH y –OH permite la identificación rápida de muestras de bioprocesos en la región del espectro NIR (700-2500 nm) o MIR (2500-40000 nm).
Se informó que la espectroscopía NIR se aplica con éxito de manera rutinaria en la biomanufactura, especialmente en pruebas de calidad de materias primas y productos finales, y de manera más amplia en el monitoreo de bioprocesos para una variedad de analitos en el procesamiento aguas arriba (por ejemplo, para una visión general) o la calidad del producto aguas abajo. La última publicación de medición avanzada en biorreactores fue especialmente útil desde el punto de vista del monitoreo de bioprocesos, ya que demostró la capacidad de la espectroscopía MIR para cuantificar agregados solubles de anticuerpos (se probaron dos anticuerpos diferentes) después de la elución de la proteína A, así como en dos diferentes sobrenadantes de cultivo de células CHO clarificados. Los autores pudieron demostrar una capacidad de predicción satisfactoria hasta el 1% de agregados en comparación con la cantidad total de anticuerpos, con coeficientes de variación inferiores al 20% para la mayoría de las muestras.
Sin embargo, el éxito de la aplicación a menudo se ve influenciado por una serie de factores interferentes, como la agitación, las burbujas de gas, los cambios de temperatura, la alimentación y los cambios en la composición del medio. Por lo tanto, el preprocesamiento adecuado de los datos y los métodos de análisis de datos multivariados son especialmente importantes en estos casos, y se discuten en las secciones siguientes.
- Optimización en biorreactores del medio para producción de células
- Optimización de Medios de Cultivo Celular para la Producción Máxima de Proteínas
- Optimización de Cultivos Microbianos para una Producción Máxima
- Diseño de experimentos y biorreactores (DoE)
- Comparación de métodos DoE para la optimización de la producción en biorreactores

