- Optimización de Medios de Cultivo Celular para la Producción Máxima de Proteínas
- Optimización de Cultivos Microbianos para una Producción Máxima
- Diseño de experimentos y biorreactores (DoE)
- Comparación de métodos DoE para la optimización de la producción en biorreactores
- Evaluación del Diseño Experimental en biorreactores.
Biorreactores de agitación orbital de un solo uso
Además de los biorreactores de mezcla de ondas y los SUB agitados, se han introducido varios otros tipos de biorreactores desechables para aplicaciones de cultivo celular durante los últimos 10 a 15 años como es el caso de los biorreactores de agitación orbital.
En un sistema de biorreactor agitado de 200 l, se lograron recuentos de células CHO de 7 × 106 células ml−1.
Se encontró una escalabilidad razonable al escalar desde tubos de 50 ml de 10 ml de volumen de trabajo hasta 200 l.
Sin embargo, los valores de kLa también están restringidos a menos de 25 h−1 en este sistema.
En promedio, los cultivos de células de mamíferos se caracterizan por una tasa específica de absorción de oxígeno de 5 a 10 pmol célula-1 día-1 (células CHO).
Al asumir una densidad celular requerida de 10 × 106 células ml−1, esto se traduce en un coeficiente de transferencia de oxígeno requerido de 15–30 h-1.
Por lo tanto, la mayoría de los SUB pueden admitir tales densidades de celdas.
Sin embargo, la transferencia de dióxido de carbono (CO2) parece ser más crítica.
La tasa de producción específica de CO2 para las células CHO es de 4–6 pmolcell−1 día−1.
La tasa de transferencia de masa del CO2 es el 89% de la del oxígeno.
El exceso de CO2 en el gas de escape (debido a la producción de las celdas) puede ser del 20 al 40%.
Por tanto, la capacidad de transferencia de CO2 requerida será inferior a la esperada:
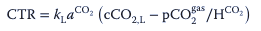
Como resultado de la ecuación el coeficiente de transferencia de masa requerido para el CO2 debe ser al menos 1,5 veces mayor que el del oxígeno para garantizar una eliminación adecuada.
Aparte de esto, se necesita suficiente aire para eliminar el CO2 de la fase gaseosa (especialmente para los sistemas de superposición de aire).
De esto se puede concluir que la transferencia de CO2 necesita un kLa 2 de al menos 40-50h-1 a una densidad celular de 10-7 células ml-1 en biorreactores de agitación orbital.
Especialmente, en la última etapa del proceso, la presión parcial de CO2 en el líquido puede aumentar a valores de 100 a 150 mm Hg.
Una alta presión parcial de CO2 conduce a un aumento de la concentración de HCO-1 en el biorreactor, y por tanto a un mayor consumo de alcalino.
Como resultado, la osmolaridad en el cultivo puede aumentar de tal manera que comienza a tener un efecto decreciente sobre la viabilidad de las células.
Por lo tanto, se necesitan estrategias de control, que incluyen el mantenimiento de la composición del gas mediante la eliminación del exceso de CO2 y el control del pH.
Es obvio que en el caso de procesos de perfusión en biorreactores de tanques de acero inoxidable, donde se obtienen densidades celulares de 108 células ml−1, se necesitan requisitos especiales para evitar la limitación de oxígeno y la inhibición por CO2 o HCO3En muchos procesos de cultivo celular a gran escala, los biorreactores de tipo onda se utilizan para la expansión.
Estos procesos en biorreactores de agitación orbital son bastante laboriosos y se requieren al menos 6 a 8 pasos para sembrar un biorreactor a gran escala (200 ly más).
En un desarrollo conjunto de, se desarrolló un proceso de siembra simplificado, donde se pueden evitar varios pasos, lo que resulta en menos mano de obra necesaria y un menor riesgo de contaminación.
Mediante la aplicación de cuerpos de plástico removibles, que pueden colocarse debajo de la bolsa de cultivo celular, se crea un canal estrecho, disminuyendo el volumen inicial del cultivo en una bolsa de 25 l.
El volumen inicial aplicable en esta bolsa se reduce a 150 ml.
Al retirar los cuerpos de plástico, la bolsa se infla aún más hasta su forma final.
Un aumento de volumen gradual se vuelve factible con esta técnica.
La aplicación de estos «bloques de canales» reduce el número de pasos de semillas en 3 o 4.
La adición de medio paso a paso se puede realizar automáticamente (según la densidad celular) o diariamente.
Una bolsa/recipiente mediano solo debe acoplarse una vez y no es necesario transferir las células de los matraces agitadores a la bolsa o de una bolsa a otra.
Debido a la flexibilidad de las bolsas, el volumen de una bolsa se puede aumentar con un factor de 100 a 150.
Un procedimiento de aumento de volumen por ese factor no es factible para SUB agitados, porque de lo contrario el impulsor no estaría tocando la fase líquida.
En general, la entrada de energía cambiaría debido a las diferentes conexiones de los agitadores a la fase líquida.
Biorreactores de ondas mixtas
La introducción de ls biorreactores de ondas mixtas en 1999, siendo la primera tecnología SUB real, se centró completamente en el cultivo de células animales, de insectos y vegetales en cultivo en suspensión.
El biorreactor de «ondas» proporciona agitación mediante el movimiento suave de la bolsa (colocada en una bandeja basculante) y las células se pueden cultivar sin que se dañen con el cizallamiento de un agitador o las burbujas coalescentes.
Sin embargo, el SUB de «onda» está claramente restringido en la capacidad de transferencia de masa de oxígeno.
Singh informa un coeficiente de transferencia de oxígeno, kLa, en el rango de 1–5 h−1, lo que respalda el crecimiento celular de 3 × 10−6 células ml−1 para células NS0 y 2,7 × 10−6 células ml−1 para células HEK293.
Estudios más recientes en SUB de tipo “onda” informan sobre cultivos en los que se logró una densidad celular de hasta 1,5 × 10−7 células ml−1 (células CHO) en un proceso de perfusión incluso hasta 500 l de volumen de trabajo.
Durante la última década, se han introducido SUB agitados hasta volúmenes de trabajo de 2000 l.
Estos sistemas consisten en una bolsa desechable, que incluye un dispositivo de agitación, comparable a los diseños de biorreactores de ondas mixtas de acero inoxidable.
La bolsa se coloca en un revestimiento de tanque de acero inoxidable, que también contiene el dispositivo de transferencia de calor (camisa calentada eléctricamente o una camisa conectada a un termocirculador).
La geometría de estos reactores agitados de un solo uso es comparable a la de los biorreactores agitados tradicionales de acero inoxidable para cultivo celular, con una relación de aspecto de altura/diámetro de 1 : 1 a 2 : 1.
Algunos de los diseños tienen un agitador ubicado excéntricamente.
El agitador está conectado mediante una unidad magnética (GE Healthcare Life Sciences – XCellerexTM) o mediante un conjunto de sellado/cojinete de un solo uso (Sartorius Stedim Biotech SA; Thermo-Fisher Scientific Inc. – HycloneTM) como parte de la bolsa sí mismo.
El último diseño requiere una instalación y conexión más laboriosa del eje y el motor, pero da como resultado un diseño de bolsa más simple.
El agitador en sí está hecho o moldeado de polietileno o policarbonato, ambos materiales USP clase VI. Por lo general, para el cultivo celular se aplican uno o dos impulsores de paletas inclinadas de 45∘.
Las bolsas cuentan con puertos para la adición de medios y bases, y para el muestreo, respectivamente.
La gasificación se realiza con un microaspersor o con un anillo aspersor, una placa porosa o un tubo abierto debajo del agitador.
Las líneas de entrada y salida de gas están equipadas con filtros preesterilizados.
El filtro de gas de salida generalmente se calienta para evitar la condensación y, posteriormente, el bloqueo de los poros del filtro.
Los coeficientes típicos de transferencia de masa de oxígeno de estos SUB son comparables con los biorreactores de cultivo celular reutilizables tradicionales y oscilan entre 4 y 30 h−1, según la velocidad del agitador y la geometría de las aspas.
La potencia de entrada en estos reactores oscila entre 2 y 70 Wm -3.
La escalabilidad de estos SUB es comparable a la de los biorreactores de tanque de acero inoxidable agitado clásicos. Las células CHO se cultivaron en un volumen de trabajo de 250 l.
El cultivo fue comparable con los cultivos de 2 l y 2000 l en reactores de vidrio y acero, respectivamente.
Estos cultivos muestran resultados comparables en términos de crecimiento y productividad en estos reactores en comparación con un cultivo de 4 l en un biorreactor de ondas mixtas de laboratorio de tanque agitado de vidrio.
En el denominado “proceso XD”, se logró una densidad celular de 1,2 – 1,4 × 108 células ml−1 en un SUB de 50 l, lo que resultó en títulos de producto de un anticuerpo tipo IgG de >10 gl−1.
Una remodelación del diseño del rociador de un Hyclone SUB de una frita a un rociador de anillo arrojó resultados similares en términos de transferencia de masa de gas a los logrados en el XDRTM.
La transferibilidad entre diferentes SUB en una escala de 1000 l fue demostrada por Minow et al.
La transferencia de un proceso por lotes alimentado con células de ovario de hámster chino de un XDR a un Hyclone SUB se basó en mantener la transferencia de masa de oxígeno o la entrada de energía.
Finalmente, se identificó un rango de operación de entrada de potencia volumétrica de 10–31 Wm−3 para el Hyclone SUB.
Esto fue un 35% más alto que el del XDR.
Recientemente, se investigó la comparabilidad del cultivo de células de Spodoptera frugiperda-9 junto con el sistema de vector de expresión de baculovirus, que expresa una fosfatasa alcalina secretada, en un biorreactor de mezcla de ondas y el un biorreactor de un solo uso agitado.
Se encontraron tasas de crecimiento, consumos de sustrato y actividades de fosfatasa máximas comparables en ambos biorreactores.
Transferencia de Masa en Biorreactores
Para evaluar la transferencia de masa en biorreactores de un solo uso y las estrategias de ampliación/reducción de escala, es necesario considerar otros parámetros de ingeniería.
La dinámica de fluidos computacional (CFD) puede contribuir a ampliar el conocimiento sobre la dinámica de fluidos provocada por las diferentes tecnologías de agitación y agitación aplicadas y biorreactores de un solo uso.
Las características del flujo de fluidos en los SUB se investigaron por medio de imágenes de partículas y velocimetría de seguimiento, anemometría láser-Doppler y anemometría de película caliente.
CFD, incluida la información de la determinación experimental del flujo de fluido, se aplicó en diferentes biorreactores agitados y de mezcla de ondas.
El resultado valioso de las aplicaciones de CFD es la estimación de las velocidades de flujo de fluidos locales, la distribución de burbujas de gas y, por lo tanto, la disipación de energía local y el esfuerzo cortante.
El estrés de cizallamiento es crucial, ya que muchos SUB se emplean para líneas celulares sensibles al cizallamiento.
Las velocidades máximas de cizallamiento pueden ocurrir cuando las burbujas colapsan en la superficie.
Sin embargo, las velocidades de cizallamiento a la velocidad de la punta del agitador también pueden dañar las células debido a la fricción que se produce cuando una pala del agitador golpea la célula.
La inclusión de CFD en los estudios de escalado permite considerar el desarrollo del esfuerzo cortante a mayor escala desde una etapa muy temprana del diseño del reactor.
El impacto de las diferentes geometrías del borde inferior debido a las limitaciones de producción se investigó en una versión convencional y de un solo uso por medio de CFD.
Se encontró que los cambios en el campo de flujo secundario fueron de menor importancia en este caso para los parámetros de ingeniería relevantes, cuando se utilizó una turbina y un impulsor de paletas segmentadas.
El mismo enfoque es adecuado para estimar la entrada de energía más adecuada para aplicaciones de cultivo celular en las que debería haber un compromiso entre el logro de una transferencia de masa de gas suficiente y fuerzas de corte no muy altas.
En un estudio CFD, que consta de un impulsor de alcance marino de bombeo ascendente, se investigó con velocimetría de imagen de partículas, combinado con un estudio del impacto de las características del flujo de fluido en el rendimiento de un cultivo celular. Se observaron compartimentaciones y turbulencias de fluidos a varias velocidades de punta y volúmenes de trabajo.
Se utilizó para el cultivo una línea celular GS-CHO que producía un anticuerpo IgG.
Los impactos sobre el crecimiento celular y la viabilidad en las condiciones aplicadas (80–350 rpm y 1–2,4 l de volumen de trabajo) apenas se observaron, aunque se detectó una reducción significativa en la productividad de la proteína recombinante a 350 rpm y 1 l de volumen de trabajo.
Bajo estas condiciones, se lograron los números de Reynolds más altos, lo que probablemente provocó fuerzas de corte localmente muy altas en este caso.
Los desafíos en la ampliación de bioprocesos en SUB en tanques de acero inoxidable son similares a los que se encuentran en los reactores convencionales. Sin embargo, los diversos diseños, que están en el mercado, requieren varios enfoques individuales.
Dado que las geometrías de los SUB agitados son similares a las de los reactores de tanque agitado convencionales, se pueden adoptar metodologías de aumento de escala, lo que hace factibles las consideraciones de aumento de escala.
Sin embargo, la limitación de la estabilidad mecánica, el mayor esfuerzo para la producción de bolsas para sistemas de agitación directa, el mayor consumo de energía y las fuerzas de cizallamiento comparativamente más altas (especialmente debido al rociado directo) no permiten señalar tales SUB agitados como un método de elección. en cada caso.
Los sistemas de agitación orbital tienen un tamaño similar, pero características de transferencia de masa de gas totalmente diferentes sin necesidad de rociado.
Los sistemas de mezcla por ola, aunque se caracterizan por una mayor huella, exhiben fuerzas de cizallamiento bajas y, en algunos casos, excelentes coeficientes de transferencia de masa de gas, lo que los hace adecuados para cultivos microbianos.
Se debe lograr una utilización más eficiente del espacio que necesitan.
Escalabilidad de biorreactores de mezcla de ondas
Para estimar la potencia de entrada en los biorreactores de mezcla de ondas, se determina la cantidad de movimiento de un movimiento bidireccional entre los ángulos correspondientes −𝜑max y 𝜑max:

El impulso se puede analizar a partir de la observación del comportamiento del flujo del fluido y el cambio correspondiente del punto de gravedad y la distribución espacial del área superficial del fluido en la bolsa. Para poder establecer una relación clásica entre la potencia de entrada y el número de Reynolds, se introdujo un número de Reynolds modificado para procesos de ondas mixtas.
Por lo tanto, se supuso que la longitud característica lC del número de Reynolds se derivaba de la sección transversal basada en la altura del líquido h y el ancho de la bolsa wb:

lB representa la longitud real (longitud máxima) de la sección transversal del fluido.
La sección transversal AC depende de la geometría de la bolsa y distingue entre mayúsculas y minúsculas. Cuando se supone que el volumen debe girarse dos veces parcialmente a lo largo de la bolsa, se supone que su velocidad es

El factor constante C depende de la parte del volumen que pasa por el punto de rotación, por lo que depende de la geometría de la bolsa, el nivel de llenado y el ángulo de balanceo. El número de Reynolds modificado para reactores de bolsa se puede definir como:

La transición entre flujo laminar y turbulento se encontró en el área entre Re = 400 y 1000. Por lo general, la turbulencia se puede lograr en SUB con mezcla de olas, si el volumen de llenado no fue muy alto o muy bajo.
El tiempo de mezcla de los biorreactores de mezcla de ondas está en un rango similar al obtenido en los SUB agitados. Como se informó, se encontró que distintas regiones del 20 % al 30 % o incluso hasta el 50 % del volumen de llenado en relación con el volumen de la bolsa producen los números de mezcla más bajos.
Esto está de acuerdo con las mediciones del coeficiente de transferencia de masa de gas kLa en SUB mezclados con olas, en los que se logra un máximo en un volumen de llenado distinto del 40% del volumen de la bolsa.
Un aumento de los números de Reynolds modificados por encima de 1000 no condujo a una mayor reducción del tiempo de mezclado.
La escalabilidad de los SUB de ondas mixtas se puede lograr si una parte de la bolsa está bloqueada para el funcionamiento, por ejemplo, a través de abrazaderas o bloques de canales.
Dado que la altura del líquido, el ángulo de balanceo y la longitud característica permanecen constantes, se mantienen entradas de potencia similares en la misma plataforma oscilante para una amplia gama de volúmenes de trabajo.
Capacidad de los biorreactores con agitación orbital
Se demostró la aplicación exitosa de SUB biorreactores con agitación orbital agitación orbital para el cultivo de líneas celulares de mamíferos desde la escala de mililitros hasta la escala de metros cúbicos.
La potencia de entrada en los sistemas orbitales sacudidos se puede determinar con una medición de torsión en el vibrador exterior (cuando se desprecia la fricción interior) o cuando se mide la temperatura del líquido y del aire en el recipiente.
El área de superficie correspondiente para el cálculo de la transferencia de masa de oxígeno puede aumentar significativamente cuando el reactor se somete a agitación orbital.
La formación de un chorro de agua conduce a la formación de una película en la pared del recipiente.
La película de agua se satura con oxígeno disuelto muy rápidamente debido a la alta relación superficie-volumen. Una vez que el núcleo de la fase líquida toca la película, se vuelve a mezclar con el núcleo líquido.
Por lo tanto, el oxígeno disuelto en la película contribuye a un valor de kLa mucho mayor.
La formación de la película depende principalmente de la geometría, el movimiento de agitación y la tensión superficial del material de la pared y la fase líquida, entre varios parámetros.
Por lo tanto, la transferencia de masa de oxígeno debe evaluarse experimentalmente para cada recipiente de cultivo. Para la aproximación del valor de kLa en matraces de agitación, Maier y Buchs desarrollaron la siguiente ecuación]:
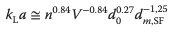
Se ha descrito el mantenimiento del tiempo de mezcla entre diferentes escalas para SUBs con agitación orbital. Para lograr esto, el diámetro interior del recipiente con respecto al diámetro de agitación y el número de Froude deben mantenerse constantes. Esto se logró en diferentes escalas, desde el mililitro hasta el rango de metros cúbicos.
Dado que la formación de una película en la pared contribuye en gran medida a la transferencia de masa del gas, las características de la superficie del material de la bolsa juegan un papel importante, así como la tensión superficial de la fase líquida.
Sin embargo, especialmente a pequeña escala, se llevó a cabo una mayor optimización de las geometrías y los materiales para lograr tasas de transferencia de masa de gas comparativamente altas.
En primer lugar, se optimizó el diseño para mejorar la transferencia de masa de oxígeno.
Se había introducido la tecnología de cobertura, que permite la aplicación de alta velocidad de agitación sin perder las capacidades de transferencia de masa de oxígeno y dióxido de carbono del sistema mediante la humectación de la membrana.
Al aplicar la tecnología de sensor de fluorescencia (PreSens), el pH, el DOT y la biomasa se pueden monitorear en línea, lo que permite el ajuste de los sistemas de liberación de sustrato in situ.
Permiten la aplicación de un modo de alimentación por lotes limitado en nutrientes en casi cualquier escala.
Mediante el control liberado con gránulos de silicio, las condiciones de cultivo de Hansenula polymorpha podrían mejorarse en matraces de agitación, lo que condujo a un aumento de la concentración de la biomasa final en un 85 % en comparación con los cultivos por lotes.
Como se informó [45], la tecnología BioLector (m2p-labs) puede combinarse con un dispositivo de control de microfluidos para ejecutar cultivos por lotes alimentados a escala de placa de micropocillos.
La alimentación constante y exponencial se puede aplicar en sistemas de biorreactores con agitación orbital paralelos impulsados por microbombas o sistemas de manejo de líquidos.
La tecnología BioLector permite además medir la concentración de biomasa, los metabolitos y las proteínas indicadoras midiendo las intensidades de la fluorescencia y la luz dispersa en línea en hasta 96 pocillos de una placa desechable.
El sistema de biorreactor en miniatura con agitación orbital 𝜇-24 (Pall Life Sciences Inc., NY) está equipado con sensores para medir el OD, la temperatura y el valor de pH.
Se demostró una alta reproducibilidad de pocillo a pocillo, que es de alguna manera crucial cuando se aplican métodos de cultivo a escala de microlitros y mililitros, para cultivos de Saccharomyces cerevisiae.
La transferencia de masa de oxígeno volumétrica aparente que se puede lograr en un sistema de este tipo con tanques de acero inoxidable osciló entre 3 y 22 h-1 para la aireación del espacio de cabeza, y entre 4 y 53 h-1 para el rociado directo de gas, respectivamente.
El rociado directo de gas redujo los tiempos de mezclado en un factor de hasta 19.
Otra contribución a los biorreactores desechables con agitación orbital completamente operados a pequeña escala es su integración en sistemas automatizados de manejo de líquidos.
Varios informes describen aplicaciones con control de procesos individuales, perfiles de alimentación y procedimientos de inducción en cultivos paralelos en plataformas de manejo de líquidos.
Por lo tanto, junto con las tecnologías independientes de la plataforma y el medio de alimentación en el tiempo (FIT), las placas de micropocillos y los matraces de agitación representan la escala inicial en la que los sistemas de biorreactores de agitación orbital completamente equivalentes son aplicables en la actualidad.
SUB biorreactores agitados
El número de mezcla 𝛷 es un parámetro que, en general, es adecuado para la caracterización de sistemas de SUB biorreactores agitados. Se define como el tiempo en el que una sustancia trazadora se distribuye por igual en la fase líquida. Habitualmente, la consecución de un valor del 95% de distribución equitativa se considera suficiente para la determinación del tiempo de mezclado. Aunque cualquier método que siga a una coloración o decoloración puede considerarse preciso, dado que se pueden identificar espacios muertos y otras áreas de mala mezcla, la aplicación de sensores de pH u otros dispositivos de control también se consideran adecuados. El principal inconveniente de tales métodos, el grado de mezcla solo se mide en la posición del sensor, se contrarresta con la facilidad y la preparación, ya que los biorreactores suelen estar equipados con sensores adecuados de todos modos.
Dado que el tiempo de mezcla es un parámetro importante para el funcionamiento de los bioprocesos, también es un criterio de escalado importante. Es de gran importancia evitar los gradientes, por ejemplo, en la adición de ácido y base para la regulación del pH o sustrato en procesos de alimentación por lotes. Por lo general, los tiempos de mezcla comparables a los de los biorreactores de tanque de acero inoxidable agitado tradicionales se logran en SUB a pequeña escala con un volumen de trabajo de hasta unos pocos litros. Se encontró que los tiempos de mezcla más bajos, que se pueden lograr en SUB agitados, están en el rango de 20 s hasta una escala de 200 l. Se alcanzan tiempos de mezcla máximos de 200 s con la entrada de potencia más baja de 1000 l. Se han realizado intentos para derivar ecuaciones para la estimación del tiempo de mezcla en SUB biorreactores agitados, lo que da como resultado la ecuación.
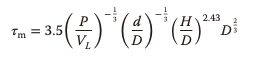
Por lo general, la entrada de energía alcanzable es comparativamente alta debido a la pequeña distancia entre el agitador y la pared y el bajo volumen de fluido a escala de laboratorio. Los SUB biorreactores agitados más grandes alcanzan la escala de metros cúbicos.
Por lo tanto, surge la pregunta clave si existe escalabilidad hacia esto de manera comparable con la gran escala, pero también con la escala muy pequeña, en la que las limitaciones técnicas y geométricas pueden dificultar las condiciones adecuadas de operación.
Entre los tamaños más pequeños de SUB biorreactores agitados disponibles se encuentra un sistema de microbiorreactor hecho de un bloque a base de polímero, que se mezcla directamente con un agitador magnético. El volumen de cultivo es de 150 μl, el DO, el valor de pH y la densidad óptica se pueden medir en línea. Las microválvulas permiten la adición de solución de alimentación o la eliminación de caldo de cultivo. Las cámaras de cultivo están hechas de plástico y se consideran desechables. Se controlan las tasas de agitación y aireación. El control del valor de pH y DO es factible a través de puntos en el fondo de la cámara de cultivo. Se llevó a cabo un proceso industrial de producción de riboflavina en modo fed-batch. Los rendimientos del producto coincidieron con los resultados obtenidos en la escala de 3 l, lo que demuestra la viabilidad de la reducción de escala al rango de mililitros.
La escalabilidad de los SUB agitados de tamaño mediano debe ser comparable con los biorreactores agitados tradicionales. La relación altura-diámetro de la línea BIOSTAT CultiBag STR fue similar para varias escalas (50, 200, 500 y 1000 l, respectivamente). En este caso, la entrada de energía aumenta para volúmenes pequeños en comparación con volúmenes grandes. Se determinó una relación máxima de entrada de energía a volumen (PV-1) para BIOSTAT CultiBag STR de 240 W m–3, 133 W m–3 y 73 W m–3 para 50, 200 y 1000 l. biorreactor, respectivamente. El UniVessel SU exhibió una mayor proporción de PV-1 de 430 Wm–3 principalmente debido al menor volumen de cultivo de un máximo de 2 l. Una proporción de PV-1 de hasta 150 W m–3 se considera adecuada para aplicaciones de cultivo celular y los SUB agitados cumplen con este requisito. Sin embargo, la combinación óptima de diferentes tipos de agitadores para mezclar y transferir masa de gas sigue siendo crucial para los SUB, ya que las tasas de agitación están restringidas debido a razones mecánicas y rentabilidad a gran escala. Se demostró que la proporción de PV-1 se reduce a más de la mitad si se utilizan impulsores de álabes de dos segmentos en lugar de una combinación de un impulsor de álabes de segmento (arriba) y una turbina Rushton.
Desafíos para la ampliación y reducción de biorreactores de un solo uso.
La ampliación y reducción de biorreactores de un solo uso se refiere principalmente a el desarrollo de bioprocesos, ya sea en biofarmacéuticos o en otros bioprocesos, exige una aceleración del proceso de ampliación.
Además, debido a las numerosas tecnologías de crecimiento que están dando lugar a una amplia gama de procesos viables con varias líneas celulares y cepas microbianas, la variedad de diferentes aplicaciones y condiciones de cultivo, especialmente en la investigación y los pasos iniciales de desarrollo del proceso, está aumentando más que en declive.
Con base en este hecho, surgen dos necesidades: (i) primero, la escalabilidad de los biorreactores es de gran interés para asegurar condiciones similares ya en la escala de laboratorio en comparación con la gran escala, y (ii) la implementación de varios sistemas desechables, que pueden satisfacer las necesidades de múltiples propósitos de cultivo y una integración en una fabricación de un solo uso de un extremo a otro.
Por lo tanto, una fabricación de extremo a extremo significa para la ampliación y reducción de biorreactores los sistemas de un solo uso se aplican en todos los pasos del proceso, creando así un excedente adicional, ya que las plataformas de construcción bastante simples de los SUB permiten un diseño personalizado mucho más fácil que los sistemas tradicionales de tanque agitado.
Un ejemplo de esto es la fácil adición de fuentes de luz que convierte un SUB común en un fotobiorreactor.
Otro es la falta de varios requisitos para la infraestructura instalada, por ejemplo, no se necesita vapor, lo que permite la instalación rápida de SUB si es necesario.
Un gran inconveniente que aún restringe la aplicación de SUB es la capacidad limitada del sensor. Muchos sensores, que han sido diseñados para reactores de tanque agitado convencionales, no se pueden montar en SUB.
Puede haber muchas razones para la no reutilización, incluido el dispositivo de medición en sí o los costos del mismo, el peso, las dimensiones o simplemente la debilidad frente a la radiación 𝛾.
Sin embargo, un equipo de sensores adecuado es necesario en el contexto de la iniciativa de la FDA de EE. UU. Para facilitar la integración de herramientas analíticas de procesos (PAT) y en paralelo para garantizar la calidad por diseño a nivel de desarrollo y optimización de procesos.
Además de los sensores adecuados, se deben integrar puertos adecuados, incluidos aquellos para soluciones de medición en línea que permitan una conexión flexible de una variedad de sensores similares a los de los biorreactores de tanque agitado tradicionales.
Con respecto a estas limitaciones y el esfuerzo creciente para cultivar en condiciones más similares en cualquier escala de desarrollo del proceso, la idoneidad para escalar hacia arriba y hacia abajo es importante.
Sin embargo, hay al menos tres grupos de conceptos de reactores desechables: (i) SUB con agitación, (ii) SUB con agitación orbital y (iii) SUB con mezcla de ondas.
Cada grupo tiene ventajas y desventajas específicas con respecto a la escalabilidad.
Aunque la ampliación y reducción de biorreactores agitados de un solo uso se puede escalar de manera similar a los reactores convencionales, esta es una tarea más desafiante para los reactores con agitación orbital y mezcla de ondas debido a la falta de conocimiento.
Sin embargo, los reactores agitados pueden funcionar de manera mucho más flexible con respecto al volumen de llenado debido a la ausencia de agitadores.
Los sistemas con agitación orbital se pueden reducir al mililitro, o teóricamente incluso a la escala de microlitros, si se aumenta la base de conocimiento para tal reducción.
Esta escalabilidad a la escala de microlitros es ciertamente más difícil para los sistemas agitados o mezclados por ondas.
Escalabilidad de biorreactores agitados de un solo uso
Debido a la similitud con los reactores de tanque agitado tradicionales bien establecidos, la entrada de energía y los números de mezcla, su influencia durante el escalado y su determinación están bastante establecidos.
Sin embargo, la escalabilidad está restringida, ya que la agitación a una escala muy pequeña no es factible en muchos sistemas del mercado.
La aplicación a gran escala está restringida a unos pocos metros cúbicos, ya que no se puede obtener estabilidad mecánica y, por tanto, velocidades de agitación considerables a mayor escala en tanques de acero inoxidable.
Un método típico y tradicional para la ampliación es el mantenimiento del orden de magnitud de parámetros clave como la relación altura-diámetro, entrada de potencia volumétrica y el tiempo de mezcla relacionado y el coeficiente de transferencia de masa de gas.
La derivación de estos parámetros es bien conocida para los reactores tradicionales de tanque agitado.
Los mismos enfoques son válidos para biorreactores agitados de un solo uso similares.
La entrada de potencia adimensional en sistemas agitados se puede derivar como número de Newton:
Ne = 𝜌Ln3d5
La entrada de potencia volumétrica en los biorreactores agitados se puede estimar en función de la medición del par en el eje del agitador:
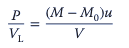
El régimen de flujo turbulento se logra en números de Reynolds aproximadamente por encima de 1000.
El número de Reynolds para los SUB agitados es el mismo que el válido para los reactores convencionales de tanque agitado:
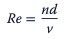
El valor de kLa se considera el parámetro más importante para aplicaciones aeróbicas microbianas.
La demanda volumétrica de oxígeno de un cultivo (tasa de absorción de oxígeno = NUESTRO) tiene que ser satisfecha por el sistema de cultivo y el valor de kLa alcanzable en él, que es el producto del coeficiente de transferencia de masa líquida kL y el área interfacial a:
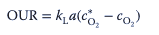
El OUR depende indirectamente de la concentración de biomasa cX y la tasa de absorción de oxígeno específica qO2.
En el caso de sistemas directamente aireados, el coeficiente de transferencia de masa de oxígeno depende principalmente del tamaño medio de la burbuja y de la fracción de volumen de gas, los cuales determinan el área interfacial gas-líquido.
En caso de que no se aplique burbujeo directo, sino aireación superficial, el área interfacial se puede estimar simplemente en función de las dimensiones geométricas, que determinan el área superficial de la fase líquida:
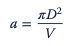
Sensores y muestreo en biorreactores
La radiación 𝛾 puede afectar en gran medida las propiedades de los Sensores y muestreo en biorreactores, especialmente las del material con características ópticas.
Aunque varios proveedores proporcionan sensores y muestreo en biorreatores de valor de pH y OD basados en tecnologías de detección óptica, aún existen limitaciones y restricciones para su aplicación.
La validez de las mediciones del valor de pH de los sensores ópticos se limita principalmente a un rango entre 6,5 y 8,5, que es suficiente para la mayoría de los procesos de cultivo celular.
Sin embargo, para los procesos microbianos, este rango puede considerarse muy estrecho.
Aparte del rango aplicable limitado, también la no linealidad de la curva de calibración y su desplazamiento después de la radiación 𝛾 pueden crear limitaciones en las aplicaciones de estos sensores.
Se están realizando avances en la aplicación de sensores y muestreo en biorreactores de pH electroquímicos más bien tradicionales o sensores de pH electroquímicos secos modificados, que pueden resistir la radiación 𝛾 y el almacenamiento en seco a largo plazo.
Varios sistemas ópticos o enzimáticos están integrados en matraces de agitación y otros dispositivos de un solo uso, como la tecnología PreSens y los sensores C-CIT.
Además de los parámetros estándar, también se aplicaron sensores y muestreo en biorreatores para medidas de impedancia, que determinan la capacitancia de las células.
La vitalidad celular es un parámetro adecuado para estimar el crecimiento y la productividad.
Los dispositivos se pueden acoplar a celdas de flujo continuo.
Los electrodos también se pueden unir a la superficie de la bolsa.
Se aplicaron medidas de radiofrecuencia no invasivas para estimar la temperatura y, lo que es más importante, la conductividad.
Nacke y col. describió la aplicación de un sensor de espectroscopia de microondas adecuado para la monitorización continua de los medios de fermentación en SUB.
Entre las frecuencias de 300 y 10 GHz, la permitividad y la conductividad se determinaron de forma no invasiva mediante la integración de una ventana dieléctrica como puerto mecánico.
Una posición adecuada de los sensores es esencial en biorreactores agitados.
Una solución es introducir el elemento sensor a través de un tubo de silicona desde la parte superior de la bolsa del biorreactor.
Sin embargo, el sensor puede secarse o flotar en la parte superior del fluido cuando se monta de tal manera, lo que interrumpirá la señal de medición.
Otra solución es ubicar un sensor en el fondo de la bolsa.
Para evitar que el sensor se seque cuando el líquido flota hacia el costado de la bolsa, el sensor se puede ubicar en una pequeña “taza” de medición, que está montada ligeramente debajo de la película plástica inferior de la bolsa.
El líquido permanece en la taza durante el movimiento de la bolsa, incluso con volúmenes de operación muy bajos.
El líquido de la taza se refresca durante el ciclo de movimiento.
El llamado «conector estéril » se utiliza para muchos SUB agitados. Se puede montar un sensor tradicional en el biorreactor en condiciones estériles.
Sin embargo, los sensores y muestreo en biorreactores deben esterilizarse en autoclave con anticipación.
Una ventaja de usar un conector de este tipo en combinación con sensores de biorreactores tradicionales es que también se pueden usar transmisores y sistemas de control establecidos y validados.
Una desventaja importante es que el sensor, en este caso, no está hecho para un solo uso y los procedimientos de validación deben realizarse en su lugar.
Para el muestreo, se utilizan muchos sistemas diferentes, incluidos conectores de muestra, donde una jeringa estéril se puede conectar a bolsas de muestreo estériles completamente preparadas.
Se han desarrollado mecanismos y herramientas para realizar muestreos libres de células mediante el uso de sistemas de membranas, que también son aplicables en biorreactores esterilizables.
Al aplicar tales métodos, también es posible una detección enzimática de glucosa y lactato.
Por tanto, los dos compuestos, que son de mayor interés durante un proceso de cultivo celular, pueden monitorizarse en línea en los SUB.
Bolsas desechables para biorreactores de un solo uso
El componente principal de los biorreactores de un solo uso son las bolsas desechables. Producidas principalmente a partir de tipos especiales de películas de polietileno, estas bolsas sirven como la cámara de reacción real. El material está en contacto con las células, los medios y el producto.
Los tipos de bolsas modernos se producen con películas multicapa, que en su mayoría se coextruyen utilizando diferentes tecnologías de extrusión (película soplada, película fundida, laminación, etc.). Los tipos modernos de bolsas desechables para biorreactores de un solo uso se producen con películas multicapa, que en su mayoría se coextruyen utilizando diferentes tecnologías de extrusión (película soplada, película fundida, laminación, etc.). La capa de contacto es en la mayoría de los casos un material de tipo polietileno (baja densidad, LDPE; baja densidad lineal, LLDPE; alta densidad, HDPE; densidad media, MDPE o ultrabaja densidad, ULDPE). Además, se aplican mezclas de estos materiales de PE o EVA (copolímero de etileno y acetato de vinilo) como material de capa de contacto. La capa de producto debe poseer características favorables con respecto a los extraíbles y lixiviables (discutidos más adelante). Como capa exterior se aplican materiales con una alta termoestabilidad (para soldadura) y buenas propiedades mecánicas (resistencia a la perforación, caída de dardos, resistencia a la tracción), incluyendo PA (Nylon6) y PET. Este material muestra buenas propiedades de barrera contra el oxígeno, el vapor de agua, el sabor, el olor y los disolventes, respectivamente.
Por lo general, se realizan varias pruebas mecánicas para garantizar el correcto funcionamiento de la película de la bolsa. Estas pruebas incluyen la investigación de la resistencia al agrietamiento, la resistencia a la tracción, la resistencia a la perforación, las pruebas de impacto de dardos y la resistencia al desgarro, entre otras. Todas estas pruebas se describen en protocolos de prueba uniformes y estandarizados (ASTM, ISO). Además, las investigaciones físicas, como las pruebas de resistencia al O2, CO2 y al vapor de agua, se realizan con base en métodos de prueba adecuados y estandarizados.
Para los productos biofarmacéuticos, la ausencia de materiales potencialmente tóxicos es crucial. Instituciones reguladoras como la EMA (Europa) y la FDA de EE. UU. (EE. UU.) Han publicado directrices. Se requiere que el equipo de producción «no presente ningún peligro para el producto» y que los materiales no sean «reactivos, aditivos o absorbentes». En las industrias, es una práctica común que el proveedor de las bolsas desechables para biorreactores de un solo uso o equipos realice evaluaciones y validaciones para confirmar la ausencia de extraíbles2) y lixiviables3) para garantizar la seguridad del producto. Aunque el nivel de lixiviables, que se originan en el biorreactor, detectado en el fármaco final es bastante bajo y el producto suele ser purificado de forma intensiva, la industria es consciente de los posibles problemas y no asume ningún riesgo al respecto.
Para probar los materiales correctamente, se han desarrollado varios procedimientos de prueba, incluido el almacenamiento de soluciones de valor de pH bajo, neutro y alto, así como etanol puro. Se aplican métodos de extracción con solventes y cromatografía de gases (GC / MS) para identificar componentes cruciales volátiles y semivolátiles. Los componentes no volátiles generalmente se identifican mediante procedimientos certificados de cromatografía líquida. La prueba de los materiales es responsabilidad de los proveedores y requiere habilidades analíticas adecuadas.
Es importante tener en cuenta que todas las pruebas deben realizarse después de la radiación 𝛾 a niveles> 40 kGy (preferiblemente hasta 50 kGy) y también después del envejecimiento de las bolsas (un mínimo de 4 meses).
Para ahorrar costos de validación y minimizar riesgos, la industria prefiere la aplicación de un solo tipo de material de película a lo largo de todo el proceso, que incluye bolsas de preparación y almacenamiento de medios, bolsas de protección y bolsas de productos farmacéuticos (intermedios).
Antes de que el proveedor libere las bolsas desechables para biorreactores de un solo uso para las entregas regulares, las bolsas también se someten a pruebas. Se realizan pruebas como la resistencia del sellado, la verificación visual, la prueba de partículas y la prueba de integridad (prueba de sobrepresión) para cada lote de bolsas de acuerdo con métodos uniformes (ASTM, USP, ISO). Periódicamente se realizan pruebas de carga biológica y endotoxinas bacterianas. Durante la radiación 𝛾 de las bolsas, se realiza un control de la dosis para garantizar que todas las bolsas hayan estado expuestas a un nivel mínimo de radiación (> 25 kGy) y no estén expuestas a un nivel muy alto de radiación (<45 kGy).
Aunque la esterilización por óxido de etileno se aplica en la industria médica, la esterilización por radiación 𝛾es el método de elección en la industria biofarmacéutica. Una gran ventaja es que la esterilización no deja residuos. Siempre que se garantice una dosis mínima (> 25 kGy), se asegura la esterilidad total. Para reducir el nivel de carga biológica y el nivel de partículas antes de la esterilización, las bolsas desechables para biorreatores de un solo uso se fabrican en salas blancas de la clase 10000. La combinación del nivel de dosificación y el nivel máximo de carga biológica está ampliamente aceptada y ha sido validada.
Una de las principales desventajas de los métodos de radiación ionizante (radiación 𝛾, 𝛽) es que todos los materiales tienen que ser resistentes a 𝛾. Esta restricción limita la elección de materiales que se pueden aplicar para el procesamiento estéril. El polietileno, que se usa comúnmente como material de película y como material para construir pilares de conexión, entre otros, puede oxidarse debido a la radiación 𝛾 en presencia de oxígeno durante la esterilización. Los materiales como el etileno-acetato de vinilo copolimerizado o los elastómeros de poliolefina poseen mejores características de resistencia a 𝛾.
Biorreactores de un solo uso, diseño, aplicaciones y desarrollo.
Los biorreactores de un solo uso, durante la última década, se han introducido con éxito en los procesos de producción y desarrollo de procesos biofarmacéuticos.
Los biorreactores de un solo uso están hechos de una bolsa de plástico, que está montada sobre una plataforma vibratoria o está rodeada por una carcasa para estabilizar su forma cuando se opera a alta presión.
Las dos partes en su conjunto sirven como un biorreactor, que más o menos mantiene las mismas características que los biorreactores tradicionales de tanque agitado, aunque existen limitaciones en las tasas de transferencia de masa de oxígeno alcanzables y los tamaños de cultivo.
Para lograr una cierta estabilidad de las bolsas de plástico, se suelen aplicar tipos especiales de películas de polietileno de alta densidad.
Todas las conexiones se realizan con tubería flexible; Los filtros desechables garantizan la esterilidad y los sensores también son desechables en la mayoría de los casos.
Las bolsas se esterilizan mediante radiación 𝛾. Por lo tanto, ya están preesterilizados en el sitio donde se realiza el cultivo.
Las bolsas se pueden vaciar después de su utilización antes del procesamiento posterior y se desechan.
Los biorreactores de un solo uso se clasifican en función de la tecnología de mezcla empleada, por ejemplo, (i) los biorreactores fijados en revestimientos de tanques (con varias construcciones para el dispositivo agitador) se denominan «agitados», (ii) los fijados en un agitador longitudinal se denominan «mezcla de ondas”, y (iii) los biorreactores de un solo uso conectados a un agitador orbital se denominan“ sacudidos orbitales ”.
Son varias las ventajas de los SUB, especialmente relevantes en la producción biofarmacéutica y los correspondientes procedimientos de certificación y validación, que reducen el esfuerzo administrativo en el sitio de producción.
Estos son principalmente la eliminación de los requisitos de limpieza, la rapidez de respuesta, la flexibilidad y la reducción de los riesgos de contaminación (cruzada).
Además, dado que no se necesita esterilización con vapor in situ, se requieren menores costos operativos y de inversión. Esto permite un aumento más rápido de la capacidad sin inversiones masivas.
Por lo tanto, la restricción de tamaño (el volumen máximo de SUB todavía está limitado a muy pocos metros cúbicos) puede contrarrestarse mediante la paralelización, aunque la viabilidad y la viabilidad económica deben investigarse caso por caso.
Los factores negativos, que se observaron durante los primeros años de aplicación de los biorreactores de un solo uso, como el riesgo de rotura de materiales plásticos y la migración de lixiviables y extraíbles, han perdido relevancia debido a la mejora de materiales y diseño de los equipos.
Sin embargo, a veces estos problemas aún pueden ocurrir y son objeto de mayor investigación y desarrollo.
Se ha entrevistado a líderes de la industria para indicar el grado (porcentaje) en el que los procesos (parte ascendente) se basan en la aplicación de tecnología de un solo uso en un estudio realizado por Langer.
Aunque en la producción comercial todavía se utilizan ampliamente equipos de acero inoxidable (en función de la capacidad instalada anteriormente y, por lo tanto, ya existente antes de la introducción de la tecnología de un solo uso), los biorreactores de un solo uso son claramente dominantes en los procesos de producción de material clínico.
Desde la introducción de la tecnología de «olas» en la década de 1990, se han introducido varios tipos de biorreactores.
Aunque, en primera instancia, solo se utilizaron biorreactores de tipo oscilante, los sistemas de agitación, que incluyen un eje desechable y palas agitadoras, se han vuelto cada vez más importantes.
Hasta la fecha, los sistemas agitados están disponibles en tamaños de 20 a 2000l, y algunos usuarios seleccionados han introducido sistemas aún más grandes como sistemas beta.
Los sistemas de tipo balancín están disponibles en tamaños con volúmenes de trabajo de <1 l hasta algunos cientos de litros.
También se aplican diseños de biorreactores alternativos, como sistemas de agitación orbital y sistemas híbridos, donde se utilizan burbujas de aire para lograr la mezcla.
Además, especialmente para aplicaciones de laboratorio, también están disponibles recipientes de policarbonato con volúmenes de trabajo de 100 ml hasta 15 l.
Recientemente, la aplicación de material de un solo uso en el rango de microlitros y mililitros bajos se está volviendo más importante como biorreactores.
El mayor grado de paralelización se obtiene en una placa de micropocillos. Sin embargo, apenas pudo interpretar esto como un biorreactor en las primeras versiones introducidas al mercado.
El propósito tampoco era la aplicación de cultivos microbianos. Sin embargo, desde entonces, nuevos desarrollos abrieron posibilidades para aplicar estas tecnologías de un solo uso para el cultivo a pequeña escala.
La mayoría de los SUB introducidos hasta ahora solo se aplican para procesos basados en cultivos de células de mamíferos.
Como los procesos microbianos (aeróbicos) normalmente requieren una entrada de energía al menos diez veces mayor para la mezcla y la transferencia de masa entre la fase líquida y gaseosa que los procesos de mamíferos, los SUB actuales no son adecuados para crear tales condiciones.
Aproximadamente el 40% de todos los productos biofarmacéuticos que se encuentran en la Fase III de desarrollo clínico se basan en procesos microbianos.
Se trata de una amplia variedad de productos, como proteínas terapéuticas y de diagnóstico, proteínas terapéuticas de bajo peso molecular, vacunas humanas y veterinarias y muchos otros productos.
Por lo tanto, también existe una fuerte demanda de equipos de un solo uso, que sean aplicables a procesos microbianos, ya que las ventajas de usar SUB también tienen en cuenta este tipo de procesos.
- Optimización de Medios de Cultivo Celular para la Producción Máxima de Proteínas
- Optimización de Cultivos Microbianos para una Producción Máxima
- Diseño de experimentos y biorreactores (DoE)
- Comparación de métodos DoE para la optimización de la producción en biorreactores
- Evaluación del Diseño Experimental en biorreactores.

